Trabajo final del Máster Oficial en Investigación Clínica Aplicada en Ciencias de la Salud (ICACS). Universitat Autònoma de Barcelona.
La neumonía adquirida en la comunidad (NAC) es una de las principales causas de hospitalización y muerte relacionada con enfermedades infecciosas en adultos1. Por lo general, la NAC se diagnostica en pacientes que presentan dos o más signos (p. ej., temperatura > 38 °C o ≤ 36 °C; recuento de leucocitos < 4 000/μL o > 10 000/μL) o síntomas (p. ej., tos nueva o que empeora, o disnea), junto con hallazgos radiográficos compatibles con neumonía (p. ej., opacidades en el espacio aéreo) y sin otra explicación alternativa2. Sin embargo, en más del 50% de los casos no se identifica el patógeno específico responsable de la infección.
Dentro del marco de la iniciativa Choosing wisely®, en febrero de 2025 se publicó3 un nuevo artículo escrito por Z. Schoepflin y B. Lubinski de Things We Do For No Reason que abordaba la solicitud de antígenos urinarios en casos de neumonía. Cada vez hay un cúmulo mayor de evidencia en contra de solicitar la prueba de antígenos urinarios para neumococo y legionella. Este artículo pretende centrarse en el antígeno urinario para neumococo (AUN).
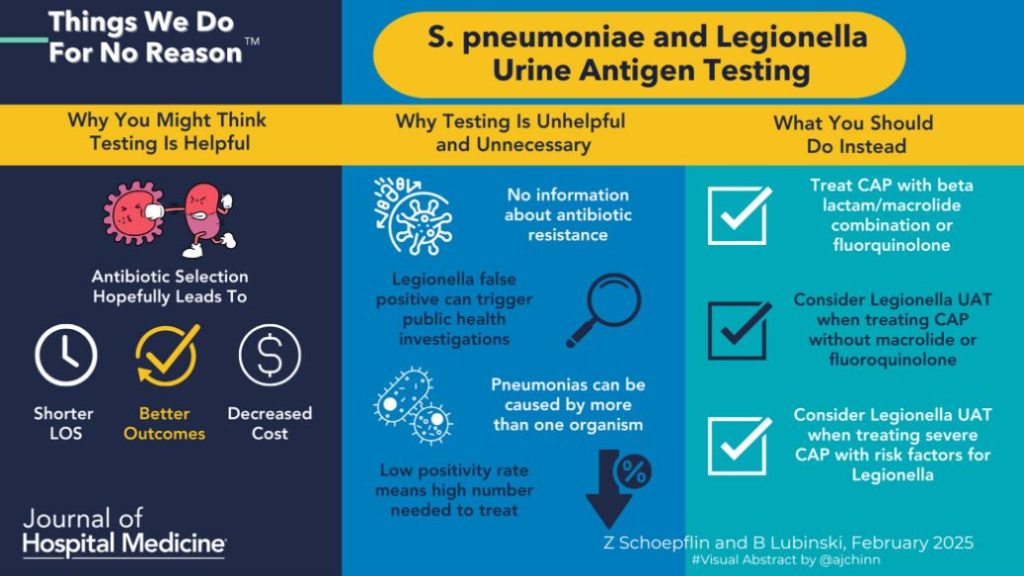
Las recomendaciones de las guías americanas (ATS/IDSA) indican solicitarlo únicamente en neumonías graves4. Hay evidencia de que no sería necesario solicitarlo en este escenario, a partir de un estudio de Athlin et al de 20225 en el cual se observó un impacto limitado en el uso de antibióticos de amplio espectro. El estudio halló que la realización de AUN no disminuyó significativamente el uso de monoterapia con betalactámicos de amplio espectro en el tercer día de hospitalización. Los principales resultados de este estudio fueron:
- Alta tasa de resultados negativos en pacientes bacteriémicos. Un hallazgo preocupante fue que casi la mitad (46%) de los pacientes con bacteriemia neumocócica obtuvieron resultados negativos en la prueba AUN. Esto plantea dudas sobre el rendimiento diagnóstico de la prueba AUN, especialmente en pacientes gravemente enfermos, lo que sugiere que la prueba puede no ser fiable en casos críticos.
- No se observó ningún efecto significativo sobre los resultados clínicos. Los estudios aleatorizados no lograron demostrar un efecto significativo en los resultados clínicos cuando el tratamiento se orientó en función de un resultado positivo de la prueba. Esto indica que incluso cuando el análisis proporciona un resultado positivo, puede no conducir a una mejora de los resultados del paciente.
- El rendimiento diagnóstico aditivo fue bajo. El estudio informó de que la prueba AUN tenía un rendimiento diagnóstico aditivo de sólo el 5,4% para el diagnóstico de la etiología neumocócica, lo que sugiere que la prueba puede no proporcionar información adicional de interés más allá de los métodos de diagnóstico existentes.
- Miedo a la recaída clínica. En los casos graves, incluso cuando los resultados de la prueba AUN fueron positivos, los clínicos tendieron a mantener regímenes de amplio espectro debido a la preocupación por una posible recaída clínica. Este comportamiento indicó una falta de confianza en la capacidad de la prueba para guiar el tratamiento de forma eficaz.
Si centramos la búsqueda de la evolución de la intervención diagnóstica en nuestro continente, investigadores de Bristol en 2020 publicaron una revisión en la que se cuestionaba la utilidad de AUN6.
Además, entre la evidencia local, ya en 2018, H. Shoji, et al.7 mostraron que la sensibilidad de la prueba del AUN había sufrido un notable descenso en un período de 15 años; con una disminución de la sensibilidad de un 76,4% (2001-2005) a un 60,5% (2011-2015), sugiriendo que la prueba podía ser menos eficaz en el diagnóstico de la neumonía neumocócica en los últimos años. Esto puede ser debido a una serie de factores. Uno de ellos incluye cambios en la distribución de serotipos, con disminución de los serotipos con alta sensibilidad a la prueba AUN, como el 9V y el 14, y aumento de serotipos asociados con una menor sensibilidad, como el 23B, el 9L/N, el 11A y el 8.
Por otro lado, ya en 2009, M. Falguera, et al.8 en Lleida realizaron un ensayo clínico randomizado en pacientes hospitalizados con neumonía. Mostró varias carencias de la prueba. Se evidenció la falta de beneficios en los resultados para el paciente: no hubo diferencias en la mortalidad, ni en las complicaciones relacionadas con la neumonía o la duración de la estancia hospitalaria entre los pacientes tratados según los resultados de las pruebas de antígenos y los que recibieron tratamiento empírico de acuerdo con las directrices. Además, sugirió que limitar el tratamiento antibiótico basándose en los resultados de los antígenos podría conducir a fracasos terapéuticos.
Con evidencia cada vez mayor de que el tratamiento dual con betalactámicos y macrólidos beneficia a los pacientes, no solo desde el punto de vista bacteriológico, sino antiinflamatorio9, con una cobertura en todos los regímenes empíricos del S. pneumoniae y siendo el AUN una prueba que no muestra sensibilidad antimicrobiana, nos parece importante que el uso de esta prueba sea infrecuente en la práctica clínica debido a su limitada precisión diagnóstica, la falta de impacto en las decisiones de tratamiento y la ausencia de beneficios en los resultados de los pacientes, así como en el costoefectividad.
Referencias
- National Institute for Health and Care Excellence (NICE). Pneumonia in adults: diagnosis and management. Clinical guideline [CG191] [Internet]. London: NICE; 2023 [cited 2025 Apr 22]. Available from: https://www.nice.org.uk/guidance/cg191.
- Vaughn VM, Dickson RP, Horowitz JK, Flanders SA. Community-Acquired Pneumonia: A Review. JAMA. 2024 Oct 15;332(15):1282-1295. doi: 10.1001/jama.2024.14796. PMID: 39283629.
- Schoepflin ZR, Lubinski BL. Things We Do for No Reason™: S. pneumoniae and Legionella urine antigen testing. J Hosp Med. 2025 Feb;20(2):178-181. doi: 10.1002/jhm.13418. Epub 2024 May 28. PMID: 38804246.
- Metlay JP, Waterer GW, Long AC, et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med. 2019 Oct 1;200(7):e45-e67. doi: 10.1164/rccm.201908-1581ST. PMID: 31573350; PMCID: PMC6812437.
- Athlin S, Magnuson A, Spindler C, Hedlund J, Strålin K, Nauclér P. Pneumococcal urinary antigen testing for antimicrobial guidance in community-acquired pneumonia-A register-based cohort study. J Infect. 2022 Aug;85(2):167-173. doi: 10.1016/j.jinf.2022.05.021. Epub 2022 May 23. PMID: 35618153.
- Hyams C, Williams OM, Williams P. Urinary antigen testing for pneumococcal pneumonia: is there evidence to make its use uncommon in clinical practice? ERJ Open Res. 2020 Jan 10;6(1):00223-2019. doi: 10.1183/23120541.00223-2019. PMID: 31956656; PMCID: PMC6955439.
- Shoji H, Domenech A, Simonetti AF, et al. The Alere BinaxNOW Pneumococcal Urinary Antigen Test: Diagnostic Sensitivity for Adult Pneumococcal Pneumonia and Relationship to Specific Serotypes. J Clin Microbiol. 2018 Jan 24;56(2):e00787-17. doi: 10.1128/JCM.00787-17. PMID: 29212700; PMCID: PMC5786729.
- Falguera M, Ruiz‐Gonzalez A, Schoenenberger JA, et al. Prospective, randomised study to compare empirical treatment versus targeted treatment on the basis of the urine antigen results in hospitalised patients with community‐acquired pneumonia. Thorax. 2010;65(2):101‐106. doi:10.1136/thx.2009.118588.
- Giamarellos-Bourboulis EJ, Siampanos A, Bolanou A, et al. Clarithromycin for early anti-inflammatory responses in community-acquired pneumonia in Greece (ACCESS): a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2024 Apr;12(4):294-304. doi: 10.1016/S2213-2600(23)00412-5. Epub 2024 Jan 3. Erratum in: Lancet Respir Med. 2024 Apr;12(4):e20. doi: 10.1016/S2213-2600(24)00043-2. PMID: 38184008.